COBERTURAS / ESMO Congress 2022
GASTROINTESTINAL
Dra. Aline Hada e Dra. Maria Cecília Mathias - 14/09/2022
“Estudo mostra resposta em 100% dos pacientes com câncer de cólon dMMR tratados com imunoterapia neoadjuvante”
LBA07 - Neoadjuvant ICI in locally advanced MMR-deficient colon cancer: the NICHE-2 study
Desenho: Fase II, não-randomizado
Elegibilidade: CRC não-metastático dMMR (cT3 e/ou N+)
Desfecho primário: Segurança e SLP 3a
Braços: 1x Ipilimumabe (1mg/kg) + Nivolumabe (3mg/kg) seguido de Nivolumabe (3mg/kg) com cirurgia ≤ 6 semanas
Resultados: Todos os pacientes operados com 100% ressecção R0.
Tempo para 1 dose de tratamento para cirurgia: 5,4 semanas
Segurança/feasibility: 98% fizeram cirurgia no tempo estabelecido
Resposta patológica: 99% - 95% MPR e 4% PR
RPC: 67%
Nossa impressão: O estudo NICHE-2 demonstrou o valor de imunoterapia neoadjuvante em CRC dMMR com quase 100% de resposta patológica sendo 67% resposta patológica completa com apenas 6 semanas de tratamento.
Tais resultados sugerem o potencial deste tratamento em se tornar a terapia padrão neste grupo de pacientes e talvez até mesmo poupar estes pacientes de cirurgia futuramente.
Dra. Aline Hada e Dra. Maria Cecília Mathias - 19/09/2022
“Nova opção de combinação de imunoterapia e inibidor de tirosina quinase em primeira linha no tratamento de carcinoma hepatocelular”
LBA35 - Camrelizumab (C) plus rivoceranib (R) vs. sorafenib (S) as first-line therapy for unresectable hepatocellular carcinoma (uHCC): a randomized, phase Ⅲ trial
Desenho: Fase III, randomizado, aberto, multicêntrico, internacional
Elegibilidade: Carcinoma hepatocelular avançado ou metastático BCLC B ou C; Child-Pugh ≤ 7
Desfecho primário: Sobrevida livre de progressão e Sobrevida Global
Braços: Camrelizumabe (200mg IV q2w) + Rivoceranibe (250mg/dia VO) x Sorafenibe (400mg 2x/dia VO)
Resultados:
(Follow-Up 7,8m) SLPm: 5,6m x 3,7m – _HR: 0,52 (IC 95% 0,41-0,65); uni-caudado p<0.0001)
(Follow-Up 14,5m) SGm: 22,1m x 15,2m - HR: 0,52 (IC 95% 0,49-0,80); uni-caudado p<0.0001)
Efeitos adversoss ≥ _G3: 80,9% x 53,4% // G5: 10 Pts x 1 pts (apenas 1 morte em cada braço tido como relacionado ao tratamento) // Hepatotoxicidade ≥ _G3: 33%
Taxa de Resposta Objetiva: 25,4% x 5,9% (p < 0,0001)
Duração de Resposta: 14,8m x 9,2m
Taxa de Controle de Doença: 78,3% x 53,9%
Nossa impressão:
A combinação de Camrelizumabe com Rivoceranibe em primeira linha para pacientes com CHC irressecável mostrou ganho em SG e SLP bem como TRO em comparação com sorafenibe.
Tal combinação mostrou-se ser mais tóxica, principalmente em relação à hepatotoxicidade, porém pode ser considerada como uma nova opção de primeira linha neste contexto – _sendo este um estudo pivotal para a combinação de imunoterapia com TKI.
Time Editorial GONNE, Aline Hada e Maria Cecília Mathias
Dra. Aline Hada e Dra. Maria Cecília Mathias - 19/09/2022
“Nova opção de inibidor de tirosina kinase em câncer colorretal metastático”
LBA12 - Efficacy of RLY-4008, a highly selective FGFR2 inhibitor in patients (pts) with an FGFR2-fusion or rearrangement (f/r), FGFR inhibitor (FGFRi)-naïve cholangiocarcinoma (CCA): ReFocus trial
Desenho: Fase 1 / 2, aberto - análise de eficácia e dose
Elegibilidade: Tumores sólidos com mutação, fusão ou amplificação FGFR2
Desfecho primário: Taxa de Resposta Objetiva, Duração de resposta, segurença
Braços: RLY-4008 (70 mg 2x/dia)
Resultados:
TxRO: 88% (na dose 70mg 2x/dia) e 63% (em todas as doses testadas)
DoR: dados imaturos – _Maioria dos pacientes seguem com o tratamento e com resposta (71%)
Tox G4/5: não observados
Maioria dos EAs são de baixo grau (estomatite, tox ungeal, Sd. mão-pé, xerostomia); 1% de descontinuação. Baixos níveis de diarreia ou hiperfosfatemia. Não houve evidência de alterações de retina.
Nossa impressão: Alterações de FGFR2 estão envolvidos na patogênese de 9 a 16% dos pacientes com colangiocarcinoma. Os iFGFR têm apresentado taxa de resposta entre 20 e 40% e mantendo duração de resposta de cerca de 9 meses. No entanto, toxicidade off-target e surgimento de resistência aos iFGFR não-seletivos limitam a sua eficácia. Desta maneira, o presente estudo mostra os dados iniciais de eficácia do RLY-4008 – iFGFR altamente seletivo para FGFR2 para mutações driver bem como de resistência de FGFR.
O RLY-4008 parece ser um iFGFR promissor no tratamento de colangiocarcinoma com fusão/rearranjo de FGFR, induzindo bloqueio de FGFR2 , porém sem bloqueio de FGFR1 (responsável pela hiperfosfatemia vista como efeito adversos de drogas da classe). No entanto, dados de SG, SLP e Duração de resposta ainda são imaturos.
Dra. Aline Hada e Dra. Maria Cecília Mathias - 19/09/2022
“Proposta de quimioterapia em combinação para o tratamento do adenocarcinoma de pâncreas avançado em segunda linha. ”
LBA60 - Evaluation of gemcitabine and paclitaxel versus gemcitabine alone after FOLFIRINOX failure or intolerance in metastatic Pancreatic Ductal Adenocarcinoma: Results of the randomized phase III PRODIGE 65 – UCGI 36 – GEMPAX UNICANCER study
Desenho: Fase III, randomizado, aberto
Elegibilidade: Adenocarcinoma de pâncreas metastático com progressão a FOLFIRINOX
Desfecho primário: Sobrevida Global
Braços: Gencitabina (1000mg/m²) + Paclitaxel (80mg/m²) D1, D8 e D15 q4w (GEMPAX) X Gencitabina (1000mg/m²)
Resultados:
SGm: 6,4 x 5,9m – HR: 0,87 (IC 95% 0,63 – 1,20; p = 0,4095) – Estudo negativo
EAG3/4: 58% x 27%
Descontinuação de tratamento: 16,7% x 2%
SLPm: 3,1m x 2,0m – HR: 0,64 (IC 95% 0,47 – 0,89; p = 0,0067)
TRO: 19,2% x 4,8% (p = 0,008)
Nossa impressão: A combinação GEMPAX não mostrou ganho de sobrevida global comparada a gencitabina porém apresentou ganhos significativos em TR e SLP, com possível maior relevância clínica em pacientes com doença sintomática. Os resultados deste estudo reforçam a necessidade de novas terapias em linhas posteriores para PDAC.
Time Editorial GONNE, Aline Hada e Maria Cecília Mathias
Dra. Aline Hada e Dra. Maria Cecília Mathias - 19/09/2022
“Avaliação de anti-EGFR de manutenção no câncer colorretal metastático. ”
LBA22 - Phase III study with FOLFIRI/Cetuximab versus FOLFIRI/Cetuximab followed by Cetuximab (Cet) alone in first-line therapy of RAS and BRAF wild-type (wt) metastatic colorectal cancer (mCRC) patients: the ERMES Study (NCT02484833)
Desenho: Fase III, randomizado, aberto, não-inferioridade
Elegibilidade: Câncer colorretal metastático virgem de tratamento
Desfecho primário: Toxicidade e Sobrevida livre de progressão
Braços: FOLRIRI + Cetuximabe até progressão ou toxicidade X FOLFIRI + Cetuximabe (x 8) seguido de Cetuximabe
Resultados:
SLPm (população modificada per-protocol: tratados com mais de 8 ciclos): 12,2m x 10m
HR: 1,3 (IC 95%: 1,03 – 1,64 – p = 0,43) – Estudo negativo.
SLPm (mPP)
Cólon D: 11,73m x 8,29m – HR: 2,07 (IC 95%: 1,20 -3,57 – p = 0,007)
Cólon E: 12,27m x 10,39m – HR: 1,16 (IC 95%: 0,88 – 1,52 – p = 0,04)
EA G≥3: 44,2% x 39,9% - Taxa de drop-out: 40%
SLPm (ITT): 10,7 x 9m – HR: 1,1 (IC 95%: 0,92 – 1,31 – p =0,39)
SGm (mPP): 30,7m x 36,6m – HR: 0,81 (IC 95%: 0,6 – 1,09 – p =0,22)
SGm (ITT): 25,3 x 31m – HR: 0,9 (IC 95%: 0,72 – 1,12 – p =0,32
Nossa impressão: O estudo foi negativo para o seu endpoint primário e falhou em não demonstrar a não-inferioridade de terapia de manutenção com cetuximabe. A análise de subgrupos demonstrou uma maior SLP para a combinação de FOLFIRI com cetuximabe até progressão de doença para os pacientes com tumores de cólon D. Além disto, o braço de terapia continuada, sem manutenção, foi mais tóxico. Os dados de SG na população ITT sugerem alguma eficácia de manutenção com anti-EGFR e talvez um grupo selecionado de pacientes possa se beneficiar desta estratégia (análise molecular está em andamento).
Time Editorial GONNE, Aline Hada e Maria Cecília Mathias
Dra. Aline Hada e Dra. Maria Cecília Mathias - 19/09/2022
“Nova opção de inibidor de tirosina kinase em câncer colorretal metastático”
LBA25 - FRESCO-2: A global phase 3 multiregional clinical trial (MRCT) evaluating the efficacy and safety of fruquintinib in patients with refractory metastatic colorectal cancer
Desenho: Fase III, randomizado, duplo-cedo, placebo controlado
Elegibilidade: câncer colorretal metastático refratário e politratado
Desfecho primário: Sobrevida Global
Braços: Fruquitinibe (5mg 1/dia 3w ON e 1w OFF q4w) x Placebo
Resultados:
Sobrevida Global mediana: 7,4m x 4,8m – HR: 0,66 (IC 95%: 0,55 – 0,80 – p < 0,001)
Sobrevida Livre de Progressão mediana: 3,7 x 1,8m – HR: 0,321 (IC 95%: 0,27 – 0,39 – p < 0,001)
TCD: 55,5% x 16,1%
TRO: 1,5% x 0%
EA G≥3: 62,7% x 50,4%
Nossa impressão: A terapia com fruquintinibe mostrou eficácia com ganho em SG em pacientes com CRCm politratados mantendo perfil de segurança tolerável, tornando-se um possível novo tratamento no cenário refratário após progressão ou intolerância a TAS-102 e regorafenibe.
Time Editorial GONNE, Aline Hada e Maria Cecília Mathias
GENITOURINÁRIO
Dr. Manuel Caitano Maia e Dra. Nathália Crusoé - 14/09/2022
Estudo apresentado no domingo 11/09 pelo Dr. Rahul Aggarwal, avaliou a intensificação de tratamento com novos agentes anti-androgênicos associados à TDA no cenário nmCPCS com dtPSA curto.
NOME: PRESTO
APRESENTADOR: Dr. Rahul Aggarwal
TÍTULO: LBA63 - A phase 3, Open-Label Study of Androgen Annihilation in Patients (pts) with High-Risk Biochemically Relapsed Prostate Cancer (AFT-19)
CENÁRIO: Intensificação de tratamento no cenário nmCPCS
CONTEXTO: Pacientes com recorrência bioquímica (RB) após prostatectomia radical e com tempo de duplicação do PSA curto estão sob maior risco de desenvolvimento de doença à distância. Além da terapia de deprivação androgênica (TDA), a intensificação de tratamento, tanto com a apalutamida quanto a abiraterona/ prednisona, levou a ganho em sobrevida global (SG) no cenário metastático de castração sensível. No presente estudo, foi testado se a adição desses agentes hormonais traz benefício em termos de SLPb no câncer de próstata não-metastático castração-sensível
MÉTODOS: Fase 3, randomizado, aberto
POPULAÇÃO - n = 503: Adenocarcinoma de próstata não-metastático (por exames convencionais) castração sensível após prostatectomia radical e após/ sem proposta de RT de resgate com recidiva bioquímica (PSA > 0,5 ng/ml) e dtPSA ≤ 9 meses
Estratificação: dtPSA < 3 meses (~ 25%) vs 3-9 meses (~ 75%)
BRAÇOS: Braço A (controle) = TDA por 52 semanas
Braço B (experimental 1) = TDA + apalutamida VO 240mg/dia por 52 semanas
Braço C (experimental 2) = TDA + apalutamida VO 240mg/dia + abiraterona 1g/dia/ prednisona 5mg/dia por 52 semanas
EP PRIMÁRIO - SLPb (PSA > 0,2 ou 2 acima do nadir): mFUP 21,5 meses
B vs A = 20,3 vs 24,9 meses (HR 0,51; IC 95% 0,35 - 0,77) p = 0,00047
C vs A = 20,0 vs 26,0 meses (HR 0,48; IC 95% 0,32 - 0,71) p = 0,00008
* benefício independente do subgrupo de dtPSA
EP SECUNDÁRIO - TRT Tox G3-4: Sem aumento no tempo para recuperação de testosterona (4 vs 3,9 vs 4,8 meses)
18,8% vs 25,2% vs 37,9% (adição de AAP associada a maior taxa de hipertensão G ≥ 2)
COMENTÁRIOS: Estudo positivo, demonstrando ganho em SLPb com intensificação de tratamento como novos agentes anti-androgênicos no nmCPCS de alto risco (dtPSA ≤ 9 meses). Apesar da não comparação direta entre os braços da APA vs APA + AAP, numericamente, não houve diferença nas medianas de SLPb, e com acréscimo de toxicidade (hipertensão) com adição da AAP. A despeito dos resultados promissores, ainda sem dados de desfechos clínicos (SML, tempo para resistência à castração). Ademais, vale ressaltar que no estudo foram utilizados exames de imagem convencionais para screening, sendo que hoje é cada vez mais estabelecido o papel dos métodos de imagem com radiofármacos no contexto da recidiva bioquímica, visto sua maior sensibilidade para detecção de doença metastática.
Braços A vs B (APA)
Braços A vs C (APA + AAP)
Dr. Manuel Caitano Maia e Dra. Nathália Crusoé - 07/10/2022
Apresentada no domingo 11/09 pelo Dr. Gerhart Attard uma análise comparativa de 2 trials do STAMPEDE, avaliando o papel da terapia combinação de abiraterona/prednisolona +/- enzalutamida à TDA no cenário mCPCS
NOME: STAMPEDE
APRESENTADOR: Dr. Gerhardt Attard
TÍTULO: LBA62 - Comparison of abiraterone acetate and prednisolone (AAP) or combination enzalutamide (ENZ) + AAP for metastatic hormone sensitive prostate cancer (mHSPC) starting androgen deprivation therapy (ADT): overall survival (OS) results of 2 randomised Phase III trials from the STAMPEDE protocol
CENÁRIO: Intensificação de tratamento no cenário mCPCS
CONTEXTO: Em pacientes com câncer de próstata metastático castração sensível (mCPCS), a associação de agentes hormonais de segunda geração com a terapia de deprivação androgênica (TDA), como abiraterona/ prednisona (abira/ pred) ou enzalutamida (enza), levou a ganho em sobrevida global. A combinação desses agentes foi avaliada no cenário metastático castração resistente (mCPCR) com ganho em sobrevida livre de progressão radiológica, no entanto sem benefício em sobrevida global. No cenário castração sensível, no entanto, não temos estudos que avaliem essa associação tripla.
MÉTODOS: Análise comparativa de 2 braços do STAMPEDE
POPULAÇÃO - n = 1919: Adenocarcinoma de próstata metastático (por exames convencionais) castração sensível
* 94% metastático de novo
BRAÇOS SOC = ADT ± Docetaxel
Comparação 1 = SOC (n = 502) vs SOC + abiraterona VO 1g/dia + prednisolona VO 5mg/dia (n = 501)
Comparação 2 = SOC (n = 454) vs SOC + abiraterona VO 1g/dia + prednisolona VO 5mg/dia + enzalutamida 160mg/dia (n = 462)
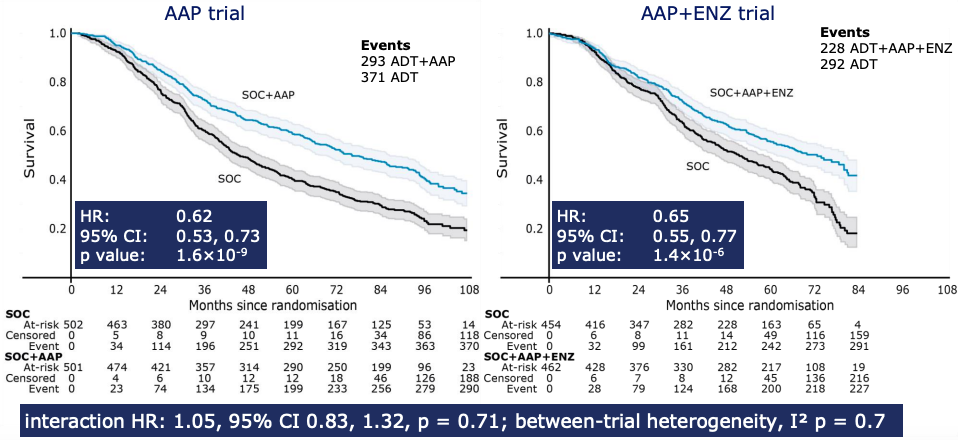
EP PRIMÁRIO - SG:
Comparação 1 (mFUP 95,8 meses) = HR 0,62 (p 0,0000000016) - SG 7 anos 30% vs 48%
Comparação 2 (mFUP 71,7 meses) = HR 0,65 (p 0,0000014)
Sem heterogeneidade entre estudos → Interação = HR 1,05 (p 0,71)
EP SECUNDÁRIO - SLPM | Tox G3-5: Comparação 1 (HR 0,50 IC 95% 0,43 - 0,58) / Comparação 2 (HR 0,52 IC 95% 0,44 - 0,62)
Comparação 1 (38,5% vs 54,4%) / Comparação 2 (45,2% vs 67,9%)
*fadiga, hepatotoxicidade, hipertensão
COMENTÁRIOS: Resultados do estudo sugerem que a adição de enzalutamida a TDA + abiraterona/ prednisolona não demonstrou ganho em sobrevida global no cenário metastático castração sensível, com acréscimo de toxicidade. Cabe ressaltar que não houve comparação direta entre os braços experimentais citados, e sim, comparação de cada combinação à TDA apenas. Ademais, após FUP 7 anos, mantido benefício em sobrevida global com uso de abiraterona associada a TDA.
DESFECHO PRIMÁRIO: Sobrevida Global
Dr. Manuel Caitano Maia e Dra. Nathália Crusoé - 14/09/2022
Estudo apresentado no sábado, 10/09, pelo Dr. Mohamad Allaf, que avaliou o tratamento perioperatório com o anti-PD-1 Nivolumabe no Carcinoma Renal localizado de alto risco e M1 sem evidência de doença.
NOME: PROSPER
APRESENTADOR: Dr. Mohamad Allaf
TÍTULO: LBA67 - Phase III RandOmized Study Comparing PErioperative Nivolumab (nivo) versus Observation in Patients (Pts) with Renal Cell Carcinoma (RCC) Undergoing Nephrectomy (PROSPER, ECOG-ACRIN EA8143), a National Clinical Trials Network trial
CENÁRIO: Tratamento perioperatório no câncer de rim localizado de alto risco e M1 sem evidência de doença
CONTEXTO: O tratamento adjuvante no carcinoma renal não é padrão, uma vez que estudos prévios falharam em demonstrar benefício em sobrevida global (SG) neste cenário com as terapias alvo direcionadas às vias VEGF e mTOR. Diante das evidências do benefício da imunoterapia na doença metastática, trials recentes têm avaliado o seu uso em cenário mais precoce. O estudo KEYNOTE-564 demonstrou ganho em sobrevida livre de doença (SLD) com o Pembrolizumabe adjuvante para grupos de alto risco de recorrência, porém ainda com dados imaturos de SG.
O presente estudo visa avaliar o tratamento perioperatório com Nivolumabe, agente anti-PD-1 com benefício comprovado na doença metastática. A despeito do possível benefício da imunoterapia adjuvante no carcinoma renal, não há evidência atual para o uso desta terapia no cenário neoadjuvante, uma vez que estudos de fase 2 demonstraram taxas de resposta de 0%, embora haja o racional biológico de que o tumor in loco permite maior geração de atividade antitumoral pela maior exposição antigênica, assim como a presença da drenagem linfonodal intacta.
MÉTODOS: Fase 3, randomizado, aberto
POPULAÇÃO - n = 819: CCR (células claras e não-células claras), ≥ T2 ou N+ ou M1 oligometastático tratado até 12 semanas da randomização (excluídos: metástases hepáticas, em ossos ou em SNC e > 3 lesões secundárias)
~50% cT3/4, ~60% pT3/4, ~15% cN1, ~3% M1, ~80% cc
BRAÇOS: Controle = Nefrectomia total/ parcial → Observação
Experimental = Nivolumabe x 1 ciclo → Nefrectomia total/ parcial após 1-4 semanas → Nivolumabe q4s x 9 ciclos após 4-10 semanas da nefrectomia
EP PRIMÁRIO - SLR: mFU 16 meses (primeira análise interina)
HR 0,97 (IC 95% 0,74 - 1,28) p = 0,43
EP SECUNDÁRIO - Tox G3-4: 33% vs 13%
COMENTÁRIOS: Discordante dos resultados previamente apresentados do estudo KEYNOTE-564 com ganho em SLD com uso do Pembrolizumabe adjuvante, o estudo atual não demonstrou benefício do Nivolumabe perioperatório, com acréscimo de toxicidade, assim como o Atezolizumabe adjuvante no estudo IMmotion010 também apresentado neste congresso. Aguardamos dados de SG, assim como resultados de outros estudos em andamento.
DESFECHO PRIMÁRIO: Sobrevida Livre de Recorrência (SLR)
Dr. Manuel Caitano Maia e Dra. Nathália Crusoé - 28/09/2022
Apresentado no Simpósio Presidencial na segunda-feira 12/09 pelo Dr. Tony Choueiri, o estudo COSMIC-313 foi o primeiro estudo a utilizar a combinação IO + IO como braço controle no tratamento de primeira linha do carcinoma renal.
NOME: COSMIC-313
APRESENTADOR: Dr. Tony Choueiri
CENÁRIO: Primeira linha do tratamento do carcinoma de células renais avançado
CONTEXTO: No cenário atual, o arsenal terapêutico de primeira linha padrão do carcinoma de células renais inclui as combinações dos inibidores de tirosina kinase (TKIs) à imunoterapia (IO) e IO + IO, estando entre as associações aprovadas o cabozatinibe + nivolumabe e nivolumabe + ipilumumabe (este último, para IMDC de risco intermediário ou desfavorável). Até o momento, não há estudos que comparem essas estratégias entre si, que utilizem como braço controle a imunoterapia, ou que avaliem o benefício da intensificação de tratamento com a combinação tripla (IO + IO + TKI).
POPULAÇÃO - n = 855: CCR com componente de células claras avançado e IMDC de risco intermediário/ desfavorável, virgem de tratamento
Estratificados: IMDC (~ 75% intermediário, ~ 25% desfavorável)
BRAÇOS: Controle = Placebo VO 1x/dia + Nivolumabe 3mg/kg IV q3s + Ipilimumabe 1mg/kg IV q3s x 4 ciclos → Placebo VO 1x/dia + Nivolumabe 480mg IV q4s (até 2 anos)
Experimental = Cabozatinibe VO 40mg/dia + Nivolumabe 3mg/kg IV q3s + Ipilimumabe 1mg/kg IV q3s x 4 ciclos → Cabozatinibe VO 40mg/dia + Nivolumabe 480mg IV q4s (até 2 anos)
EP PRIMÁRIO - SLP: mFUP 20,2 meses
11,3 meses vs NA (HR 0,73; IC 95% 0,57 - 0,94 p 0,013) - 1 ano 49% vs 57%
* análise de subgrupo: sugere ausência de benefício para IMDC risco desfavorável (HR 1,04; IC 95% 0,65 - 1,69)
EP SECUNDÁRIO - TR Tox G3-4:
36% vs 43%
41% vs 73%
COMENTÁRIOS: Estudo positivo para o seu endpoint primário, com ganho em SLP da combinação tripla, além de ganho em TR, porém sem ganho em SG até o momento (dados imaturos), e com acréscimo de toxicidades não desprezível. Análise de subgrupo sugere ausência de benefício na população de risco IMDC desfavorável, subgrupo de pior prognóstico, onde esperava-se maior magnitude de benefício com a intensificação do tratamento. Diante da toxicidade elevada e ausência de dados de SG até o momento (necessário maior tempo de seguimento), não fica claro o papel da terapia tripla como padrão de tratamento de primeira linha do CCR face à presença de outras combinações menos tóxicas disponíveis.
Dr. Manuel Caitano Maia, Dra. Nathália Crusoé - 28/09/2022
Apresentado como destaque no Simpósio Presidencial no domingo 11/09 pelo Robert Motzer, o estudo CheckMate 914 foi mais estudo avaliando o papel da imunoterapia adjuvante com nivolumabe + ipilimumabe no carcinoma renal células claras.
NOME: CheckMate 914
APRESENTADOR: Dr. Robert Motzer
TÍTULO: LBA4 - Adjuvante nivolumab plus ipilimumab (NIVO+IPI) vs placebo (PBO) for localized renal cell carcinoma (RCC) at high risk of relapse after nephrectomy: results from the randomized, phase 3 CheckMate 914 trial - Parte A
CONTEXTO: O tratamento adjuvante no carcinoma renal não é padrão, uma vez que estudos prévios falharam em demonstrar ganho em sobrevida global (SG) com as terapias alvo direcionadas às vias VEGF e mTOR. Diante das evidências do benefício da imunoterapia na doença metastática, trials recentes têm avaliado o seu uso em cenário mais precoce. O estudo KEYNOTE-564 demonstrou ganho em sobrevida livre de doença (SLD) com o Pembrolizumabe adjuvante para grupos de alto risco de recorrência, porém ainda com dados imaturos de SG. O estudo atual visa avaliar a combinação do Nivolumabe + Ipilimumabe (parte A) adjuvante, já aprovada no cenário metastático em primeira linha.
MÉTODOS: Fase 3, randomizado, duplo-cego, placebo-controlado
POPULAÇÃO - n = 816: CCR alto risco (pT2a G3/4 N0, pT2b-T4 N0 ou pN1), 4-12 semanas após nefrectomia parcial/ total com margens negativas, predominância de células claras
~75% pT3 N0, ~ 5% componente sarcomatóide
BRAÇOS: CONTROLE = Placebo x 24
EXPERIMENTAL = Nivolumabe 240mg q2s x 12 + Ipilimumabe 1mg/kg q6s x 4
EP PRIMÁRIO - mSLD: mFUP 37 meses 50,7 meses vs NA (HR, 0,92 IC 95% 0,71 - 1,19, p 0.5347) - SLD 24 meses 76.4% vs 74.0%
EP SECUNDÁRIO - SG Tox G3-5: Imaturo 28% vs 2%
COMENTÁRIOS: Assim como os estudos IMmotion 010 e PROSPER, que avaliaram o Atezolizumabe e Nivolumabe, respectivamente, o estudo atual traz resultados negativos para o seu desfecho primário, sem ganho em sobrevida livre de doença da combinação Nivolumabe + Ipilimumabe como tratamento adjuvante para carcinoma renal células claras de alto risco para recorrência. Resultados estes conflitantes com o benefício em SLD visto com o Pembrolizumabe visto no estudo KEYNOTE 564. Aguardamos dados de SG e maior tempo de FUP dos estudos para melhor entendimento do real benefício da imunoterapia adjuvante no câncer de rim.
Dr. Manuel Caitano Maia e Dra. Nathália Crusoé - 06/10/2022
Apresentado no Simpósio Presidencial na segunda-feira 12/09 pelo Dr. Chris Parker, o estudo RADICALS-HD avaliou a adição e o tempo de duração da terapia de deprivação androgênica (TDA) associada à radioterapia (RT) após prostatectomia radical (PR)
NOME: RADICALS-HD
APRESENTADOR: Dr. Chris Parker
TÍTULO: LBA9 - Duration of androgen deprivation therapy (ADT) with post-operative radiotherapy (RT) for prostate cancer: first results of the RADICALS-HD trial (ISRCTN40814031)
CENÁRIO: Adição e tempo de duração da TDA à RT pós-PR
CONTEXTO: Após prostatectomia total, o benefício da associação da terapia de deprivação androgênica (TDA) à radioterapia (RT), assim como sua duração, ainda é incerto. Estudos prévios sugerem ganho SCE e SG com adição de bicalutamida por 2 anos, assim como tendência a ganho em SLP e SLM com adição de TDA po 6 meses, principalmente nos pacientes de alto risco (Gleason ≥ 8, pT ≥ 3, margens positivas e PSA pré-RT > 0,7). O estudo atual visa avaliar a adição e o tempo de duração da TDA à radioterapia de resgate na recorrência bioquímica pós-PR.
MÉTODOS: Fase 3, randomizado, aberto
POPULAÇÃO - n = 2839:
Adenocarcinoma de próstata localizado após PR candidato a RT
None vs Short (n = 1480) mPSA 0,2 / 16% T3b/4 / 3% N+ / 11% Gleason ≥ 8 / 62% margem +
Short vs Long (n = 1523) mPSA 0,2 / 30% T3b/4 / 8% N+ / 29% Gleason ≥ 8 / 63% margem +
BRAÇOS:
None (controle) = RT sem TDA
Short = RT + TDA por 6 meses
Long = RT + TDA por 24 meses
EP PRIMÁRIO - SLM:
mFUP 9 anos
None vs Short = 10 anos 79% vs 80% (HR 0,89; IC 95% 0,69 - 1,14, p 0,35)
Short vs Long = 10 anos 72% vs 78% (HR 0,77; IC 95% 0,61 - 0,97, p 0,03)
EP SECUNDÁRIO
Tempo para TDA: None vs Short (HR 0,54; p < 0,0001) - 10 anos 73% vs 82%
Short vs Long (HR 0,73; p 0,005) - 10 anos 69% vs 75%
SG: None vs Short (HR 0,88; p 0,42) - 10 anos 86% vs 85%
Short vs Long (HR 0,88; p 0,38) - 10 anos 82% vs 85%
COMENTÁRIOS: Estudo demonstra ganho absoluto de 6% em 10 anos em SLM ao estender o tempo de TDA de 6 para 24 meses em associação à RT (para pacientes com característica de maior risco). Como não houve ganho em SG, devemos pesar risco/ benefício de estender o tempo do bloqueio hormonal de acordo com perfil/ preferência do paciente, levando em consideração toxicidades e QoL. Já na comparação sem TDA 0 vs 6 meses, não foi demonstrado benefício em SLM ou SG com adição do bloqueio hormonal.
GINECOLÓGICO
Dra. Carla Cavalcanti e Dra. Mila Cruz Oliveira - 14/09/2022
Pacientes com câncer cervical avançado e já tratadas com quimioterapia a base de platina apresentam mal prognóstico e arsenal terapêutico limitado.
O EMPOWER-Cervical 1 é um estudo de fase III que comparou Cemiplimab, agente anti-PD-1, com quimioterapia em monoterapia à escolha do investigador, para 2ª linha do câncer cervical recorrente ou metastático após progressão a esquemas contendo platina. O recrutamento aconteceu independentemente da expressão de PD-L1. O desfecho primário do estudo é sobrevida global, analisada hierarquicamente na população CEC seguida da população global, se positiva.
608 pacientes foram randomizadas (1:1) para receber Cemiplimab 350mg em ciclos de 21 dias por até 2 anos ou uma quimioterapia por escolha do investigador. Havia estratificação de acordo com PD-L1, região, uso prévio de bevacizumab, histologia e ECOG. Conforme esperado, havia predominância da histologia de células escamosas na amostra, compondo aproximadamente 78% da totalidade de pacientes.
Os investigadores trazem análise exploratória de eficácia conforme expressão de PD-L1 por TPS (≥1% vs <1%).
Em fevereiro de 2022, os dados de sobrevida global da 2ª análise interina do estudo foram publicados na revista New England, demonstrando superioridade do Cemiplimab em relação ao controle com quimioterapia. Nesta ocasião, com seguimento mediano de 16,8 meses, o estudo foi interrompido com base no cut-off pré estabelecido para eficácia.
Na ESMO de 2022, tivemos acesso aos dados de sobrevida global mais maduros, após seguimento mediano de 30,2 meses. Na população CEC, a mediana de sobrevida global foi 10,9 meses vs 8,8 meses em favor do Cemiplimab (HR 0,69, 95% IC 0,56-0,85, p 0,00023), diminuindo o risco de morte em 31%. Já na população global, a mediana de SG foi de 11,7 vs 8,5 meses em favor do Cemiplimab (HR 0,66, 95% IC 0,55-0,79, p 0,00001), diminuindo o risco de morte em 34%.
Em relação a análise exploratória conforme expressão de PD-L1, 61% das amostras tumorais foram analisadas e o Cemiplimab mostrou-se superior à quimioterapia independentemente da expressão (HR 0,61 para PD-L1 <1% e HR 0,65 para PD-L1 ≥1%).
Assim, o seguimento mais prolongado reforça o papel do Cemiplimab como possibilidade terapêutica em 2ª linha no câncer cervical.
Referências:
- Krishnansu S Tewari et al. Survival with Cemiplimab in Recurrent Cervical Cancer. N Eng J Med. 2022.
- Ana Oaknin et al. Phase III EMPOWER-Cervical 1/GOG-3016/ENGOT-cx9 trial of cemiplimab in recurrent or metastatic (R/M) cervical cancer: Long-term survival analysis. ESMO 2022
Dra. Carla Cavalcanti e Dra. Mila Cruz Oliveira - 06/10/2022
Câncer de ovário avançado em primeira linha
“O SOLO 1 testou a manutenção com Olaparibe para as pacientes com mutação do BRCA, visando adiar recidivas e aumentar a chance de cura após primeira linha. A análise prévia demonstrou que 48% das pacientes que receberam Olaparibe estavam livres de progressão em 5 anos de seguimento. Agora temos acesso à atualização de sobrevida global com seguimento de 7 anos”.
5170: Overall survival at 7-year follow-up in patients with newly diagnosed advanced ovarian cancer and a BRCA mutation who received maintenance olaparib in the SOLO1/GOG 3004 trial
Desenho: Fase III, randomizado (2:1), controlado por placebo
Eligibilidade: Câncer de ovário avançado (EC III-IV) com mutação de BRCA, recém-diagnosticado, após cirurgia (upfront ou de intervalo) e QT baseada em platina
Desfecho primário: sobrevida livre de progressão
Braços: Olaparibe 300mg 12/12h por 2 anos x Placebo
Resultados: Com follow up de 7 anos, a mediana de sobrevida global para as pacientes que receberam 2 anos de Olaparibe de manutenção ainda não foi atingida, (HR 0,55, IC95% 0,40–0,76). Embora sem significância estatística, este resultado tem relevância clínica inquestionável, considerando-se também que 44% das pacientes do controle receberam iPARP em linhas subsequentes. No marco de 7 anos de seguimento, 67% as pacientes que receberam Olaparibe estão vivas e 45% estão livres de terapia subsequente, versus 46,5 e 20,6% no grupo controle, respectivamente.
Nossa impressão: O Olaparibe de manutenção na população com mutação do BRCA adia as recidivas e aumenta as chances de cura no câncer de ovário avançado. Na era da medicina de precisão, todas as pacientes devem ser testadas!
Sobrevida global com seguimento mediano de 7 anos
Dra. Carla Cavalcanti e Dra. Mila Cruz Oliveira - 06/10/2022
Câncer de ovário avançado em primeira linha
“Na primeira análise, a adição de Olaparibe ao Bevacizumabe de manutenção após 1ª linha com QT baseada em platina + Beva prolongou a sobrevida livre de progressão, particularmente nas pacientes com HRD+. Na ESMO 2022, vimos os dados de sobrevida global do estudo”.
LBA29: Final overall survival (OS) results from the phase III PAOLA-1/ENGOT-ov25 trial evaluating maintenance olaparib (ola) plus bevacizumab (bev) in patients (pts) with newly diagnosed advanced ovarian cancer (AOC)
Desenho: Fase III, randomizado (2:1), controlado por placebo
Eligibilidade: Câncer de ovário avançado (EC III-IV), recém-diagnosticado, após cirurgia (upfront ou de intervalo) e QT baseada em platina + Bevacizumabe. Inclusão independentemente do status HRD e BRCA.
Desfecho primário: sobrevida livre de progressão
Braços: Olaparibe 300mg 12/12h por 2 anos + Bevacizumabe por 15 meses x Placebo por 2 anos + Bevacizumabe por 15 meses
Resultados: Com follow up mediano maior que 5 anos, o estudo foi negativo para SG na população ITT (HR 0,92, 95% IC 0,76–1,12; p 0,4; SG em 5 anos: 47,3 x 41,5%). É importante considerar, porém, que 45% das pacientes do controle receberam iPARP em linhas subsequentes. Já para o subgrupo HDR+, houve ganho em SG independentemente do status BRCA (HR 0,62, 95% IC 0,45–0,85; SG em 5 anos: 65,5 x 48,4%). Não houve benefício da adição do Olaparibe para as pacientes HDR-.
Nossa impressão: Essa atualização consolida o papel dos iPARP em combinação ao Bevacizumabe no câncer de ovário com deficiência de recombinação homóloga. Todas as pacientes devem ser testadas para o planejamento terapêutico.
Sobrevida global com seguimento mediano maior que 5 anos
MAMA
Dr. Carla Cavalcanti e Dr Nivaldo Vieira - 14/09/2022
Overall survival (OS) results from the phase III TROPiCS-02 study of sacituzumab govitecan (SG) vs treatment of physician's choice (TPC) in patients (pts) with HR+/HER2- metastatic breast cancer (mBC)
Câncer de mama avançado RH+/HER-2 negativo resistente à terapia endócrina e politratado
“Vimos na ASCO 2022 os dados positivos para sobrevida livre de progressão, desfecho primário. Agora o congresso europeu traz a segunda análise interina com atualização da sobrevida global”.
LBA76: Overall survival (OS) results from the phase III TROPiCS-02 study of sacituzumab govitecan (SG) vs treatment of physician's choice (TPC) in patients (pts) with HR+/HER2- metastatic breast cancer (mBC)
Desenho: Fase III, randomizado (1:1), aberto
Eligibilidade: Câncer de mama avançado RH+/HER-2 negativo após pelo menos 1 linha de HT, 1 iCDK4/6 e 1 taxano em qualquer cenário e entre 2-4 linhas de QT no cenário metastático.
Desfecho primário: sobrevida livre de progressão
Braços: Sacituzumab govitecan versus Quimioterapia por escolha do investigador
Resultados: Com follow up mediano de 12,5 meses, a segunda análise interina apresentada pela Dra Hope Rugo demonstrou que o Sacituzumab govitecan é superior para sobrevida global em relação à QT por escolha do investigador. Houve redução do risco de morte em 21% (HR 0,79, IC95% 0,65-0,96), com mediana de sobrevida global de 14,4 meses para o SG vs 11,2 meses para o controle.
Nossa impressão: o Sacituzumab govitecan, conjugado droga anticorpo inovador e que já demonstrou eficácia no câncer de mama triplo negativo, agora é incorporado ao arsenal terapêutico da doença HR/HER-2 negativa politrada.
Sobrevida global na segunda análise interina com seguimento mediano de 12,5 meses
Dr. Carla Cavalcanti e Dr Nivaldo Vieira - 15/09/2022
Interim overall survival (OS) results of abemaciclib plus a nonsteroidal aromatase inhibitor (NSAI) in patients (pts) with HR+, HER2- advanced breast cancer (ABC)
Câncer de mama avançado RH+/HER-2 – em 1ª linha
“Os estudos MONALEESA-2 e PALOMA-2 divergiram quanto à sobrevida global dos iCDK4/6 em 1ª linha. Dados finais do estudo MONARCH 3 são aguardados para consolidar o papel do Abemaciclibe neste cenário”.
LBA15: Interim overall survival (OS) results of abemaciclib plus a nonsteroidal aromatase inhibitor (NSAI) in patients (pts) with HR+, HER2- advanced breast cancer (ABC)
Desenho: Fase 3, randomizado (2:1), duplo-cego, controlado por placebo
Eligibilidade: Câncer de mama avançado RH+/HER-2 negativo, pós-menopausa, 1ª linha
Desfecho primário: sobrevida livre de progressão
Braços: Anatrozol ou letrozol + Abemaciclibe x Anatrozol ou letrozol + Placebo
Resultados: Abemaciclibe em combinação com Inibidor de aromatase não esteroidal já é aprovado em 1ª linha desde a publicação de 2017 demonstrando ganho de PFS. Na ESMO 2022 vimos a segunda análise interina de sobrevida global com follow up mediano de 5,8 anos: embora com ganho numérico superior a um ano para a combinação, ainda não houve ganho estatisticamente significativo (mSG: 67,1 x 54,5 meses; HR 0.754, P=0.0301). Eficácia também é demonstrada numericamente na população com doença visceral (mSG 65,1 x 48,8 meses; HR 0.708, P=0.0392). Dados finais são aguardados em 2023.
Nossa impressão: é necessário aguardar a análise final para melhor conclusão, mas a diferença numérica maior que um ano a favor do Abemaciclibe já é um resultado excelente. Também chamam atenção positivamente: mediana de sobrevida global que ultrapassa 5 anos, inclusive na população com doença visceral, que pode ser poupada de quimioterapia.
Sobrevida global na segunda análise interina com seguimento mediano de 5,8 anos
Dr. Carla Cavalcanti e Dr Nivaldo Vieira - 06/10/2022
Câncer de mama Triplo Negativo localizado
“Na doença triplo negativa, o padrão ouro atual é a combinação de anti-PD1 e quimioterapia neoadjuvante. Sabe-se que altos níveis de TILs (tumor-infiltrating lymphocytes) correlaciona-se com melhor prognóstico. Seria esse um bom preditor para desescalonamento do tratamento? Poderemos abrir mão da quimioterapia nesse cenário?
LBA13: Nivolumab and ipilimumab in early stage TNBC with tumor-infiltrating lymphocytes (TILs) - First results from the BELLINI trial
Desenho: Fase II, não randomizado, estudo tipo basket
Eligibilidade: Câncer de mama Triplo Negativo cT1c-T3, cN0-N+ com TILs ≥5%
2 coortes com n= 15 pacientes, das quais: 5 pacientes com TIL low (5-10%), 5 pacientes com TIL intermediate (11-49%) e 5 pacientes com TIL high (≥50%)
Desfecho primário: Aumento ≥2x no número de células CD8 e/ou IFNy após 4 semanas de tratamento
Tratamento:
Coorte 1: Nivolumabe por 4 semanas ???? Terapia padrão com QT e cirurgia
Coorte 2: Nivolumabe + Ipilimumabe por 4 semanas ???? Terapia padrão com QT e cirurgia
Resultados: Após 4 semanas de tratamento com Imunoterapia, todas as pacientes foram submetidas à avaliação de resposta por RNM, com 19% de RP na coorte Nivo e 27% de RP na coorte Ipi+Nivo. Das 7 pacientes respondedoras, nenhuma apresentava TILs low. Houve também avaliação de resposta patológica por biópsia após a imunoterapia: 7 pacientes não apresentavam células tumorais na amostra (NT= no tumor, no gráfico). 3 pacientes negaram quimioterapia neoadjuvante e foram operadas após a imunoterapia, 1 das quais apresentou pCR. 53% e 60% dobraram a expressão de CD8 e/ou IFNy nas coortes 1 e 2, respectivamente, atingindo, assim, o desfecho primário do estudo. 24% das pacientes apresentaram negativação do ctDNA após 4 semanas de imunoterapia.
Nossa impressão: Apesar de ser um estudo de fase II com amostra pequena de pacientes, esse estudo traz dados importantes sobre o papel isolado da imunoterapia no câncer de mama localizado. Ainda não está claro, porém, se poderemos abrir mão da quimioterapia no futuro.
Resposta radiológica e patológica após 4 semanas de imunoterapia
PULMÃO
Bárbara Lafayette e Ana Clara Sousa - 11/09/2022
A atualização dos dados com mais 2 anos de follow up demonstram uma manutenção do benefício em SLD com uso de osimertinibe adjuvante, em relação ao placebo, consistente com a análise inicial e reforçando o uso da medicação neste cenário.
QUANDO: Domingo, 11/09/22, 08:30-08:40 - Brest Auditorium
Proffered Paper session: Non-metastatic NSCLC and other thoracic malignancies
NOMES: ADAURA
Título: Osimertinib as adjuvant therapy in patients (pts) with resected EGFR-mutated (EGFRm) stage IB-IIIA non-small cell lung cancer (NSCLC): Updated results from ADAURA
CENÁRIO: CPNPC EGFRm - Doença localizada
CONTEXTO ATUAL: Osimertinibe é um inibidor de tirosina quinase de terceira geração, que age inibindo os receptores do fator de crescimento epidérmico (EGFR) que possuem mutações de sensibilidade e a mutação de resistência T790M.
O uso do osimertinibe é considerado o tratamento padrão para pacientes com CPNPC metastático EGFR mutados, incluindo aqueles com metástases em sistema nervoso central (SNC).
Assim, no ADAURA avalia-se o impacto do uso do osimertinibe no tratamento adjuvante de pacientes com CPNPC EGFRm com doença localizada (EC IB - IIIA) completamente ressecados. Com base nos resultados preliminares já apresentados, o uso do osimertinibe já foi aprovado pelas agências regulatórias americana e brasileira para uso neste cenário. A avaliação atual, com um follow up mais prolongado, é importante para observarmos a consistência dos dados.
MÉTODOS: Fase 3, multicêntrico, randomizado (1:1)
POPULAÇÃO: CPNPC EGFRm, EC IB-IIIA completamente ressecados
BRAÇOS (n): Controle: Placebo +/- quimioterapia adjuvante (n: 343)
Experimental: Osimertinibe adjuvante por 03 anos (n: 339)
EP PRIMÁRIO: Sobrevida livre de doença (SLD) nos estadios II-IIIA, avaliado pelo investigador
EP SECUNDÁRIO: SLD nos estadios IB-IIIA, sobrevida global (SG) e segurança
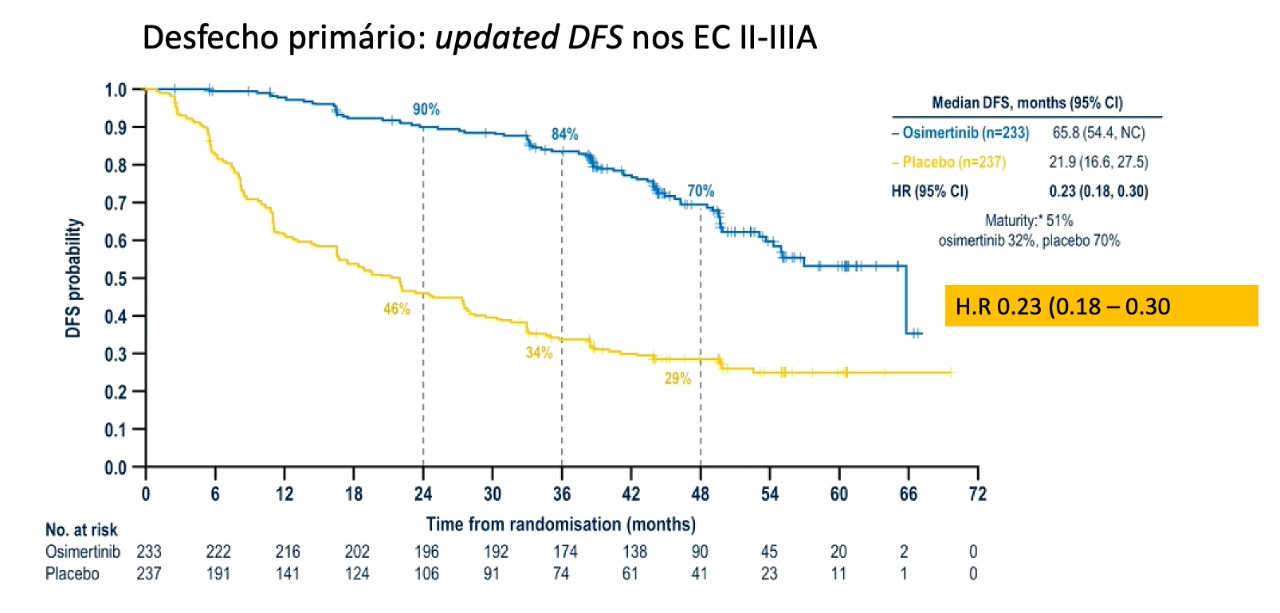
RESULTADOS: Na atualização dos dados após mais dois anos de follow up, avaliando-se a população com EC II-IIIA, demonstrou-se uma redução do risco de recidiva ou morte de 77% (HR: 0,23 IC 95% 0,18-0,30; 51% maturidade dos dados), com uma sobrevida livre de doença em 3 anos de 84% nos pacientes que fizeram uso de osimertinibe x 34% dos pacientes no braço placebo. Na população geral, ou seja, EC IB-IIIA, demonstrou-se uma redução do risco de recidiva ou morte pela doença de 73% (HR 0,27 IC 95% 0,21-0,34), bem como uma SLD em 3 anos de 85% para os pacientes que fizeram uso do osimertinibe x 44% no grupo placebo.
Em relação à sobrevida livre de doença em SNC, demonstrou-se uma redução do risco de 76% nos pacientes com EC II-IIIA.
COMENTÁRIOS: A atualização dos dados com mais dois anos de follow up demonstram uma manutenção do benefício em SLD para os pacientes que fizeram uso do osimertinibe, em relação ao placebo, consistente com a análise inicial.
Os autores consideram que estes dados reforçam o uso do osimertinibe adjuvante como uma terapia padrão para os pacientes com CPNPC EGFRm EC IB-IIIA após ressecção completa (em adição à quimioterapia adjuvante, quando indicada).
Drª Bárbara Lafayette e Drª Ana Clara Sousa - 15/09/2022
“O CodeBreak 200 consolida o uso do sotorasibe como terapia padrão no cenário de CPNPC metastático com mutação em KRAS G12c, após progressão de doença a quimioterapia com platina e imunoterapia.”
A presença de mutações ativadoras em KRAS é observada em 25-30% dos CPNPC não escamosos, representando a mais prevalente mutação driver nesta população. Dentre as mutações ativadoras de KRAS, a KRAS p.G12c é a mais frequente, sendo observada em aproximadamente 13% dos adenocarcinomas de pulmão.
No estudo CodeBreak 100, foi avaliada a atividade clínica e segurança do sotorasibe, um inibidor oral irreversível do KRAS G12c, em pacientes com esta mutação no cenário metastático previamente tratado, sendo demonstrada uma TRO de aprox 40% e um perfil de segurança aceitável.
Seria o sotorasibe superior ao docetaxel para esse perfil de pacientes?
O CodeBreak 200, apresentado na sessão presidencial da ESMO 22, foi um estudo de fase III, randomizado (1:1), aberto, multicêntrico, que avaliou o uso de sotorasibe 960mg/d x docetaxel 75mg/m² a cada 3 semanas, no cenário de pacientes com CPNPC metastático KRAS G12c mutado, pós progressão de doença a uma ou mais linhas incluindo quimioterapia à base de platina e imunoterapia (concomitante ou sequencial).
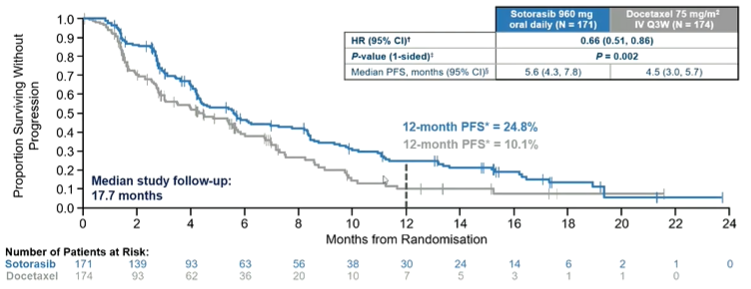
O estudo foi positivo para seu endpoint primário, com um ganho em SLP em favor do uso do sotorasibe, com SLPm de 5,6m x 4,5m - HR 0,66 (0,51-0,86 – p: 0,002), sendo a SLP em 12 meses de 24,8% x 10,1%. Também foi observada uma maior TRO: 28,1% x 13,2%, maior controle de doença: 82,5% x 60,3%, além de maior duração de resposta: 8,6m x 6,8m.
No entanto, o estudo foi negativo para SG, porém vale ressaltar que houve um cross over de 34% para o sotorasibe, após PD ao docetaxel.
Em relação ao perfil de segurança, foi observada uma menor taxa de eventos adversos G≥3 e maior tempo de uso da medicação no braço experimental.
Assim, o CodeBreak 200 consolida o uso do sotorasibe como terapia padrão no cenário de CPNPC metastático com mutação em KRAS G12c, após progressão de doença a quimioterapia com platina e imunoterapia.
Endpoint Primário: Sobrevida Livre de Progressão (SLP)
Referências:
Skoulidis, F. et al, Sotorasib for Lung Cancers with KRAS p.G12C Mutation, N Engl J Med 2021;
Johnson, M. et al, Sotorasib versus docetaxel for previously treated non-small cell lung cancer with KRAS G12C mutation: CodeBreaK 200 phase III study – LBA 10, ESMO 22
Time Editorial GONNE: Bárbara Lafayette e Ana Clara Sousa
Drª Bárbara Lafayette e Drª Ana Clara Sousa - 16/09/2022
“O uso do atezolizumabe monodroga se torna uma excelente opção para tratamento dos pacientes com CPNPC metastático, em 1ª linha, não elegíveis a platina”
O tratamento padrão para os pacientes com câncer de pulmão não pequenas células (CPNPC) metastático em primeira linha inclui imunoterapia associada ou não a quimioterapia, a depender da expressão do PDL1. No entanto, ≥ 40% dos pacientes neste cenário possuem ECOG ≥2 e/ou comorbidades que limitam o uso de quimioterapia à base de platina e os quais não foram representados nos principais estudos pivotais.
Com o racional de avaliar o uso da imunoterapia de forma isolada para tratamento dos pacientes com CPNPC metastático não elegíveis à platina, foi desenhado o IPSOS. Estudo de fase 3, global, randomizado e aberto, que incluiu mais de 450 pacientes com performance comprometida (ECOG ≥2) ou com ≥70 anos, ECOG 1 e comorbidades que limitassem o uso de platina. Os pacientes eram randomizados (2:1) pra atezomizumab 1200 mg a cada 3 semanas ou quimioterapia (vinorelbine ou gencitabina) a cada 3 ou 4 semanas.
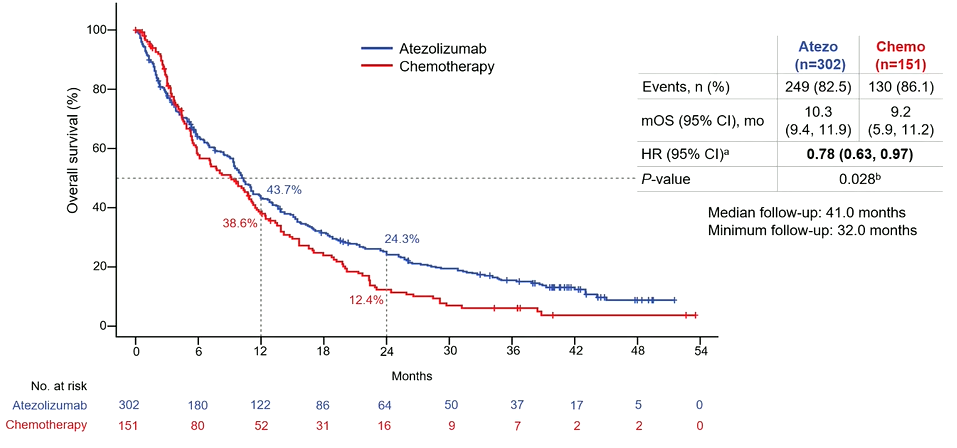
O estudo foi positivo para seu desfecho primário de sobrevida global, com uma redução do risco de morte de 22% e demonstrando uma SG mediana de 10,3m x 9,2m em favor da imunoterapia. Chama atenção que, aos 24 meses havia o dobro de pacientes vivos no braço do atezolizumabe (24,3% x 12,4%). Vale ressaltar que o benefício ocorreu independente da expressão de PDL1.
O estudo foi negativo para o endpoint secundário de sobrevida livre de progressão, porém foi positivo para os demais desfechos, demonstrando um benefício em TRO (16,9% x 7,9%) e duração de resposta (14m x 7,8m), e apresentando também uma menor ocorrência de eventos adversos ≥3.
Assim, o uso do atezolizumabe monodroga torna-se uma excelente opção para tratamento dos pacientes com CPNPC metastático em 1ª linha não elegíveis a platina, uma vez que demonstrou ganho de SG em relação à quimioterapia, consistente entre todos os subgrupos (incluindo diferentes percentuais de PD1), além de apresentar um melhor perfil de segurança.
Sobrevida Global (SG)
Referências:
- Lee, S. et al, IPSOS: Results from a phase III study of first-line (1L) atezolizumab (atezo) vs single-agent chemotherapy (chemo) in patients (pts) with NSCLC not eligible for a platinum-containing regimen; ESMO 22.
Time Editorial GONNE: Bárbara Lafayette e Ana Clara Sousa
Dra. Bárbara Lafayette e Dra. Ana Clara Sousa - 19/09/2022
“Os dados de follow up de 5 anos, além de demonstrarem uma manutenção consistente do benefício da associação de QT e pembro, apontam também que os pacientes que completaram os 35 ciclos de imunoterapia apresentaram taxas de resposta objetiva mais profundas, e também uma maior sobrevida global.”
A associação de pembrolizumabe a quimioterapia à base de platina levou a ganhos em sobrevida global (SG) e sobrevida livre de progressão (SLP), quando comparados à quimioterapia isolada, em pacientes com CPNPC, em 1ª linha, de histologia não escamosa e escamosa, conforme publicações prévias dos estudos KEYNOTE- 189 e KEYNOTE-407, respectivamente. Em sessão oral da ESMO 22, foram apresentados os dados com follow up mais prolongado (de 5 anos).
A atualização dos dados demonstrou que, apesar da ocorrência de aproximadamente 50% de crossover entre os braços, ambos estudos demonstraram de forma consistente com as apresentações iniciais um aumento significativo em SG com uso da imunoterapia associada à quimioterapia. No KN 189, a SG mediana foi de 22 meses para a combinação x 10,6 meses no braço de quimioterapia isolada, com uma redução do risco de morte de 40% e uma SG em 5 anos de 19,4% x 11,3%. De forma semelhante, no KN 407 a SG mediana foi de 17,2 meses para a combinação x 11,6 meses para o braço controle, com uma redução do risco de morte de 29% e uma SG em 5 anos de 18,4% x 9,7%.
Dentre os pacientes que completaram os 35 ciclos de pembrolizumabe, no KN 189 estes apresentaram uma taxa de resposta objetiva (TRO) de 86%, e uma SG em 3 anos de 71,9%. Já no KN 407, a TRO destes pacientes chegou a 90,9% e uma SG em 3 anos de 69,5%.
Assim, as apresentações dos dados de follow up de 5 anos demonstram uma manutenção do benefício em sobrevida global do uso da combinação de imunoterapia com quimioterapia para tratamentos dos pacientes com CPNPC com doença metastática em 1ª linha. Além disso, fica claro também que os pacientes que completam os 35 ciclos de pembrolizumabe possuem melhores desfechos.
Sobrevida Global – KN 189 (com follow up de 5 anos)
Sobrevida Global – KN 407 (com follow up de 5 anos)
Referências:
Gandhi, L. et al, Pembrolizumab plus Chemotherapy in Metastatic Non–Small-Cell Lung Cancer, NEJM 2018;
Paz-Ares, L. et al, Pembrolizumab plus Chemotherapy for Squamous Non–Small-Cell Lung Cancer, NEJM 2018;
Garassino, M. et al, 973MO: KEYNOTE-189 5-year update: First-line pembrolizumab (pembro) + pemetrexed (pem) and platinum vs placebo (pbo) + pem and platinum for metastatic nonsquamous NSCLC, ESMO 22
Novello, S. et al, 5-year update from KEYNOTE-407: Pembrolizumab plus chemotherapy in squamous non-small cell lung cancer (NSCLC), ESMO 22
Time Editorial GONNE: Bárbara Lafayette e Ana Clara Sousa
Drº Bárbara Lafayette e Drº Ana Clara Sousa - 26/09/2022
“Importante trabalho apresentado na sessão presidencial da ESMO22 pelo Dr Charles Swanton, que relaciona a poluição à ocorrência de câncer de pulmão não pequenas células EGFR mutado em pacientes não tabagistas”
Nos últimos anos, foi observado um aumento na incidência de câncer de pulmão não pequenas células (CPNPC) em pessoas não tabagistas. A ocorrência de mutações driver, incluindo mutações em EGFR, é observada frequentemente nesta população, entretanto, o mecanismo pelo qual se dá o desenvolvimento do câncer neste subgrupo de pacientes não está bem estabelecido. Por outro lado, a poluição do ar já foi associada a um maior risco de desenvolvimento do CPNPC, porém o mecanismo por trás dessa relação causal também não está claro.
Poderia a ocorrência do câncer de pulmão não pequenas células com mutação EGFR estar associada a poluição do ar?
Após avaliação de dados individuais de 463.679 indivíduos do Biobanco do Reino Unido, expostos a concentrações mais altas de poluição, mensurada através da exposição a partículas de 2,5 micrômetros de diâmetro chamado de material particulado (MP2,5), demonstrou-se um aumento do risco de algumas neoplasias, incluindo uma maior chance de desenvolver câncer de pulmão (HR: 1,16). Dados populacionais da Inglaterra, Coreia do Sul e Taiwan demonstraram também uma maior ocorrência de CPNPC EGFR mutado em pessoas expostas a uma maior concentração de MP2,5.
Os autores também demonstraram, através da análise histológica de amostras teciduais pulmonares obtidas em indivíduos sem câncer de pulmão, a ocorrência de mutações driver em EGFR (éxons 18 e 21) em 15% de indivíduos saudáveis. Além disso, estudos adicionais observaram que há uma maior ocorrência de mutações driver em tecidos normais com o aumento da idade.
Em paralelo, os pesquisadores utilizaram modelos murinos nos quais induziram mutações somáticas em EGFR e KRAS, e os expuseram ao MP2,5 de forma sistemática, demonstrando o desenvolvimento de câncer de pulmão nestes modelos. O mecanismo principal envolvido no surgimento da neoplasia acontece pelo potencial promotor e pelo estímulo à progressão tumoral ocasionado pela exposição à poluição.
A inflamação do epitélio pulmonar causada por essa exposição, levou a uma maior atração de macrófagos e secreção de interleucina 1ẞ, a qual age promovendo a regeneração celular através da indução do surgimento células alveolares tipo 2, consideradas células progenitoras do adenocarcinoma EGFR mutado.
Por fim, o autor apresentou os dados do CANTOS trial, que apontaram que o uso de anti-IL1ẞ é capaz de reduzir a incidência de câncer de pulmão, sendo um possível alvo para quimioprevenção.
Nosso comentário: Estes dados, apresentados em conjunto na sessão presidencial da ESMO 22, são de grande relevância, uma vez que demonstram através de dados epidemiológicos e de modelos pré clínicos, o papel da poluição do ar (MP2,5) na promoção do câncer de pulmão, além de trazerem respostas acerca do mecanismo através do qual se dá o surgimento de câncer de pulmão em não fumantes.
Eles embasam também a existência de um modelo alternativo de carcinogênese, no qual há ocorrência de mutações oncogênicas em células de tecidos normais, que sofrem estímulo promotor de carcinógenos, a exemplo da poluição induzindo uma maior concentração de IL1ẞ, e posterior desenvolvimento tumoral.
Por um lado, o trabalho traz reflexões humanitárias importantes acerca da necessidade de preocupação mundial com a geração e exposição a poluentes e, por outro, traz o racional de buscar o uso de anti-IL1B na fase pré clínica do câncer na tentativa de barrar o seu desenvolvimento.
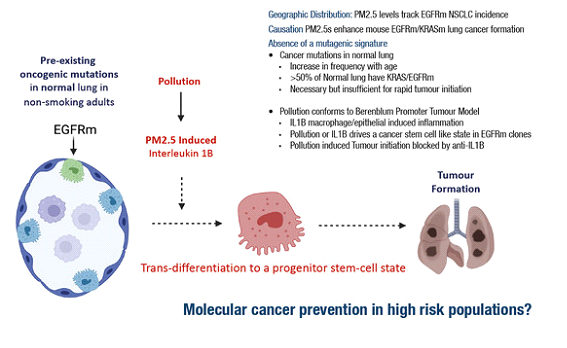
Time Editorial GONNE: Bárbara Lafayette e Ana Clara Sousa
Referências:
- Swanton, C. et al., Mechanism of action and an actionable inflammatory axis for air pollution induced non-small cell lung cancer: Towards molecular cancer prevention, ESMO Congress 22, Abstract LBA1
Dra Bárbara Lafayette e Dra. Ana Clara Sousa - 28/09/2022
Uma opção de tratamento eficaz para os pacientes com CPNPC mestastático EGFR mutado pós progressão a osimertinibe é necessidade não atendida. Em 15-30% dos pacientes, o mecanismo de resistência se dá através da amplificação de MET (METamp). O INSIGHT 2 avalia o papel do tepotinibe (anti-MET) neste cenário, com resultados animadores.
Uma opção de tratamento eficaz para os pacientes com câncer de pulmão não pequenas células (CPNPC) EGFR mutado pós progressão a osimertinibe é necessidade não atendida. Em 15-30% dos pacientes, o mecanismo de resistência se dá através da amplificação de MET (METamp). Assim, a utilização de medicações anti-MET, como o tepotinibe, podem ser eficazes.
O INSIGHT 2 é um estudo de fase 2, aberto, que incluiu pacientes com CPNPC metastático EGFR mutado, pós progressão de doença ao osimertinibe em 1ª linha, com amplificação de MET (METamp). A presença da amplificação era avaliada pelo FISH em amostra tecidual e/ou NGS na biópsia líquida. Os pacientes eram divididos em 2 braços, sendo para uso da combinação de osimertinibe e tepotinibe, com 88 pacientes, e outro para uso de tepotinibe isolado, este com 12 pacientes.
O desfecho primário do estudo era a avaliação da taxa de resposta objetiva (TRO) nos pacientes com METamp confirmado por FISH, no braço tepotinibe + osimertinibe. Os desfechos secundários eram TRO nos pacientes com METamp avaliado por biópsia líquida, no braço tepotinibe + osimertinibe, e TRO nos pacientes com METamp (FISH ou biópsia líquida), no braço tepotinibe monoterapia.
Foi observada uma TRO de 54,5% dos pacientes com METamp avaliada por FISH, que fizeram uso da combinação tepotinibe + osimertinibe. De forma semelhante, nos pacientes que tiveram MET avaliado por biópsia líquida e em uso da combinação, a TRO foi de 50%. Já em relação aos pacientes do braço tepotinibe isolado, a TRO foi de apenas 8,3%.
Em relação à segurança, não foi observado um sinergismo entre os eventos adversos (EA), sendo o perfil de segurança da combinação semelhante ao perfil das medicações isoladas, com uma ocorrência de EA ≥3 observada em 23,9%.
Assim, a combinação de tepotinibe e osimertinibe apresentou atividade promissora para tratamento de pacientes com CPNPC EGFRm pós progressão ao osimertinibe em 1ª linha. Em contrapartida, o uso de inibidor de MET isolado, sem bloqueio do EGFR, não parece uma estratégia eficaz.
Esse estudo demonstra a importância da identificação dos mecanismos de resistência no momento da progressão da doença desses pacientes, através de biópsia líquida ou tecidual, com o objetivo de guiar os tratamentos subsequentes.
Referências:
Tepotinib + osimertinib for EGFRm NSCLC with MET amplification (METamp) after progression on first-line (1L) osimertinib: Initial results from the INSIGHT 2 study, LBA 52: ESMO Congress 2022